DISPLASIA RENALE GIOVANILE
Di che cosa si tratta?
Iniziative della SIC

Relazione del Dr. Claudio Brovida
Per saperne di più si rimanda alla seguente lettura tratta dal sito della dogenes e gentilmente tradotta dalla Dr. ssa Elisabetta Venturini ed alla relazione del dr. Brovida.
DISPLASIA RENALE GIOVANILE -Traduzione
DISPLASIA RENALE GIOVANILE (JDR) o NEFROPATIA GIOVANILE (JNP)
L’articolo che segue da me tradotto, è stato scritto dal Dr. dr. Mary H. Whiteley Ph.D. della DOGenes Inc. (https://www.dogenes.com) dopo autorizzazione dell’autrice. Il lettore o la lettrice troverà delle mie note aggiuntive indicate con un asterisco * con lo scopo di semplificarne la comprensione.
DISPLASIA RENALE GIOVANILE (JDR)
La scoperta della mutazione e lo sviluppo di un test diretto su DNA per la diagnosi genetica della Displasia Renale Giovanile.
Che cosa è la JRD? Significa “Juvenile Renal Dysplasia” (JRD) è una importante categoria di malattie renali nel cane.
La displasia è definita come: “crescita anormale o lo sviluppo anormale di cellule o organi”. Nel caso della JRD il rene non riesce a svilupparsi correttamente durante l’embriogenesi nel grembo materno. Alla nascita si ritrovano nel rene, strutture glomerulari, tubulari anomale, con alterazioni anche dell’interstizio del parenchima renale, che sono persistenti per tutta la vita dell’animale.
La JRD può presentarsi con una vasta gamma di sintomi clinici ed alterazioni patologiche.
La diagnosi definitiva di JRD è fatta tramite una biopsia a cuneo, che rivela lesioni di tipo displasico, quali glomeruli immaturi e tubuli anormali.
Inpidui con una biopsia anormale possono essere tuttavia completamente asintomatici, senza mostrare alcun segno della malattia.
In alcuni casi, però alcuni soggetti possono presentarsi con i segni classici della fase terminale della insufficienza renale cronica (ICR), o tra questi due estremi.
Tenuto conto di questo ampio spettro di sintomi (da asintomatici a francamente sintomatici) gli inpidui affetti da JRD genetica, ma non clinica di solito passano inosservati, e vengono riprodotti. È per questo che lo sviluppo di un test genetico è stato necessario per la gestione e l’eliminazione di questa malattia.
JRD un esame più da vicino
“Quello che si vede non è sempre quello che si ottiene”.
Per quegli allevatori che negano che JRD sia un problema presente nel loro allevamento, si vedrebbe questo se fossero state fatte biopsie sui tutti i cani da loro allevati.
Di seguito una sintesi di un articolo del dottor Kenneth C. Bovee, pubblicato nell’ottobre di 2003: il dottor Kenneth C. Bovee, ricercatore presso la Pennsylvania University, ha pubblicato i risultati di un suo studio durato 10 anni, relativo alla razza Shit Tzu, che ha coinvolto 143 cani e 52 accoppiamenti.
Le sue conclusioni mostrano chiaramente che la maggior parte dei riproduttori alla biopsia aveva un certo livello di glomeruli fetali, e le stime di questo studio hanno indicato che la prevalenza di questa anomalia (che significa biopsia positiva per glomeruli fetali) è stata circa dell’85% nei 143 soggetti oggetto dello studio, ma la percentuale dei casi clinici reali, ossia soggetti che avevano manifestato una grave disfunzione renale era stata bassa.
Altra conclusione critica di questo studio di 10 anni, è stata che gli animali con una bassa percentuale di glomeruli fetali riprodotti, avevano progenie con malattia renale; non solo, soggetti con lo 0% di glomeruli fetali (biopsia negativa), ha comunque comportato la nascita di prole con 1-3% glomeruli fetali.
L’incidenza apparentemente bassa della malattia è dannosa per i riproduttori, perché adulti apparentemente normali, potrebbero non essere rilevati e produrre progenie con soggetti affetti.
Un dato importante, è che utilizzo dei dati bioptici per cercare di controllare questa malattia nella popolazione, ha limitato in una certa misura la produzione di progenie gravemente interessata, senza permettere l’eliminazione della trasmissione di una biopsia positiva ai figli dai genitori.
Il Dr. Bovee ipotizzò, sulla base di questi risultati che la modalità di ereditarietà non era semplicemente recessiva, ma poteva seguire un modello di dominante con penetranza incompleta.
Per cui, concluse il suo studio, evidenziando la necessità dello sviluppo di un test genetico per controllare questa malattia in questa razza e nelle altre razze colpite.
Parole più vere non sono mai state pronunciate!
Susan L Fleisher, una privata cittadina statunitense, una profana dal punto di vista della medicina veterinaria, tramite internet ha scritto alcune delle pagine web più complete sulla displasia renale, e le malattie renali congenite e/o ereditarie, raccogliendo e citando persi articoli scientifici.
La sua tragedia personale, ossia la morte del suo cucciolo di barboncino standard di JRD, la spinse a ricercare ogni genere d’informazione sulla malattia che ha portato alla fine prematura del suo cane.
La sua pagina web non è solo ben referenziata dalla letteratura scientifica, ma la sua citazione riportata qui sotto, sintetizza il principale problema oggi giorno legato alla JDR.
Questa sua pagina web è stata scritta più di un decennio fa, ma la frustrazione legata a questa malattia e il mancato riconoscimento di questa come genetica, rimane ancora oggi diffuso.
La signora Susan, è mancata nel 2007, ma la sua eredità resta on-line all’indirizzo web: http://www.vetprof.com/clientinfo/juvenilerenal.html
Riportiamo una citazione della stessa:
“Le informazioni che ho raccolto da allora, mi portano a credere che la maggior parte dei singoli casi di JRD siano trattati da parte dei proprietari e dei veterinari, come eventi isolati, piuttosto che come la manifestazione di una malattia genetica. Se l’allevatore è informato di un problema sospetto congenito/ereditario in un cucciolo che ha venduto, e spesso è solo il proprietario della fattrice che ne è informato, questo viene trattato come un incidente isolato. A meno che non vi sono casi multipli in una stessa cucciolata, il problema rimane in gran parte sconosciuto, e non viene sospettato come genetico, e che questo problema possa essere presente anche negli altri membri della cucciolata, né pensato che possano essere portatori.”
Quali razze hanno JRD?
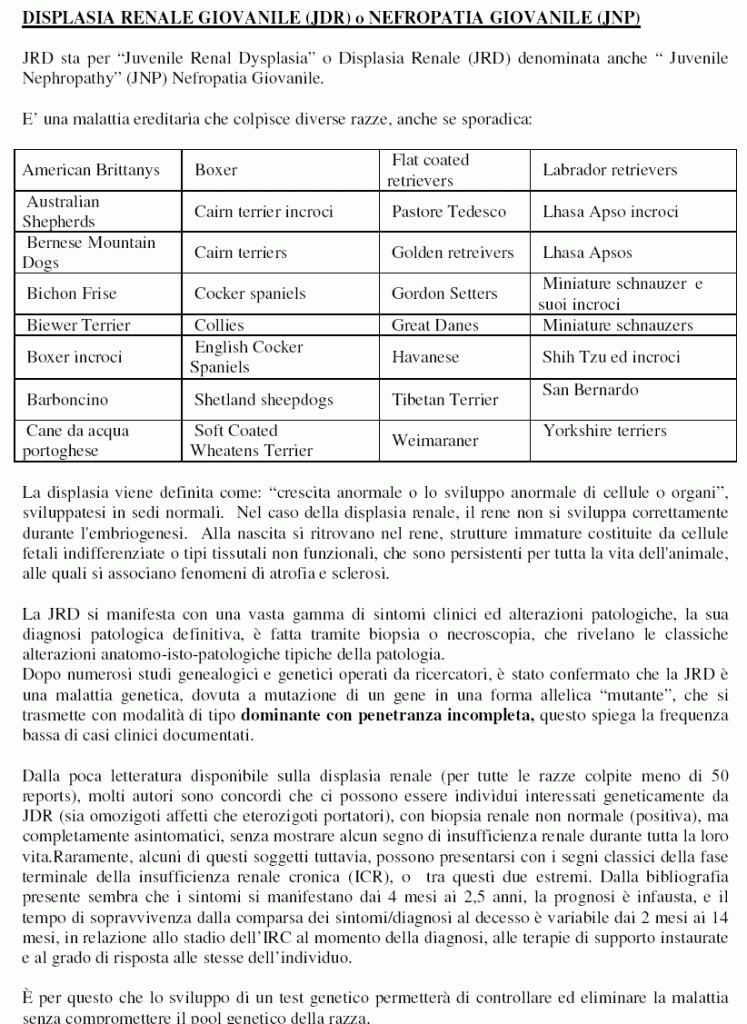
Molte razze di cani sono affette da JRD, e questo è stato documentato nei testi di medicina veterinaria, così come nei reports di casi clinici in letteratura scientifica.
La DOGenes ha messo a punto il test per 28 razze e incroci!
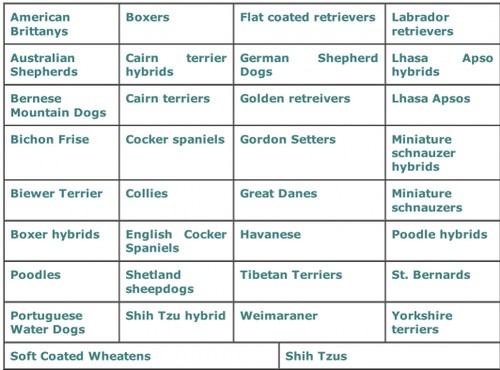
Queste razze affette da JDR conpidono un fenotipo comune, caratterizzato da glomeruli immaturi, e / o tubuli immaturi e persistente mesenchima.
La JRD è in gran parte ritenuto un problema di salute delle razze “Lhasa Apsos”, e “Shih Tzu”. Ma questo non è vero!
Il dilemma del cane meticcio. “Il cane meticcio” è un termine applicato ai figli di genitori di razza con il gene mutato per la JDR, che viene ereditato come carattere autosomico dominante a penetranza incompleta. Pertanto, qualsiasi incrocio di cane con un genitore del nostro gruppo di razze che può portare la mutazione JRD, la può passare alla sua progenie anche non di razza pura (ibrido).
Fare un incrocio tra due razze note per essere portatrici del gene JDR aumenta ulteriormente il rischio di diffusione della malattia. Finora, la frequenza della mutazione della JRD è elevata in tutte le razze che la DOGenes ha studiato, con l’eccezione del cane pastore tedesco.
Come si trasmette la JRD ?
La modalità di trasmissione della JRD è stata ampiamente dibattuta, in quanto questa malattia può presentarsi con una vasta gamma di sintomi e differente quadro patologico.
La diagnosi definitiva di JRD in vita, è fatta da un prelievo di tessuto renale, mediante biopsia a cuneo (il termine biopsia significa prelievo di tessuto in vita), rivelerà lesioni di tipo displasico a carico dei glomeruli o delle tubuli renali; se il prelievo di tessuto avviene post-mortem, si parla di necroscopia.
Si possono avere inpidui con biopsia positiva per la JDR, completamente asintomatici, senza alcun segno di malattia, oppure ci possono essere inpidui con biopsia positiva che presentano i segni classici dell’insufficienza renale cronica (IRC) allo stadio terminale, o tra questi due estremi.
Dato quest’ampia varietà di quadri clinici, gli inpidui affetti di solito passano inosservati, e vengono riprodotti senza criterio.
Per questo lo sviluppo di un test genetico è fondamentale per la gestione e l’eliminazione di questa malattia. Inoltre, un test genetico può essere usato per indicare e comprovare la modalità di ereditarietà.
Attraverso studi genealogici, la modalità di trasmissione è stata finalmente confermata come dominante con penetranza incompleta.
Lo sviluppo di un test genetico in DOGenes.
Durante lo sviluppo del feto, alcuni geni influenzano con un meccanismo a cascata lo sviluppo di vari organi e delle strutture che compongono gli organi stessi (questo meccanismo come a un domino: se un tassello del domino manca, gli altri sono soliti svolgere il suo compito per lo svolgimento delle loro funzioni). Dal momento che ogni cellula contiene due copie di ogni gene, la copia non mutata può essere sufficiente per completare la cascata di eventi (eredità recessiva).
Il genoma umano (46 cromosomi, in 23 coppie)* contiene circa 25.000 coppie di geni, e il genoma canino (78 cromosomi in 39 coppie)* è probabile che contenga circa lo stesso numero.
Di queste coppie di geni, perse centinaia possono essere dedicate alla maturazione di organi specifici.
Non tutti questi tessuti, sono codificati da geni specifici, ossia non sono assolutamente essenziali per lo sviluppo di specifici tipi cellulari, come è stato dimostrato nei topi “knockout” (topi geneticamente modificati, ossia privati di determinati geni)*; alcuni geni sono stati completamente eliminati, senza nessun effetto visibile sul animale.
(perché un gene può codificare per un determinato carattere, oppure un carattere può essere codificato da più geni)*.
Nel caso della displasia renale studiata in determinati animali utilizzati come modelli, quali il topo geneticamente mutato, fattori di trascrizione (geni che codificano per proteine che attivano altri geni) o fattori di crescita (i geni che codificano per proteine che promuovono la crescita delle cellule), sono stati implicati come causa della malattia.
Un approccio, per scoprire i geni che causano malattie genetiche (uomo compreso)*, è quello di utilizzare geni candidati, noti per causare malattie specifiche in organismi modello, come il topo, il ratto, il pesce zebra o il moscerino della frutta.
Questo è stato l’approccio utilizzato nella ricerca, per trovare la mutazione della JRD nel cane.
Dopo il sequenziamento nel DNA canino di sei geni candidati, la mutazione è stata finalmente identificata, in un Lhasa Apsos, e in uno Shih Tzu.
Questa mutazione è stata poi scoperta in altre razze con la displasia renale, e un test genetico diretto, ora è disponibile per molte razze affette da questo disturbo.
Attraverso studi genealogici, la modalità di trasmissione è stata finalmente svelata come Dominante con penetranza incompleta.
Esempi di Pedigree
Di seguito sono riportati esempi di pedigree di “Soft coated wheaten terrier” (una razza interessata dalla JRD) che dimostrano che la malattia viene ereditata come dominante con penetranza incompleta.
Nel primo esempio, due SCW Terrier,omozigoti per l’ allele mutato (con tutti e due le copie di gene mutato = affected) sono stati accoppiati.
Pertanto, tutti i figli sarebbero omozigoti affetti, avendo tutti due alleli mutati (ereditati da ciascuno dei genitori).
In questa cucciolata, in un solo cucciolo è stata diagnosticata clinicamente la displasia renale a 4 mesi di età. La diagnosi è stata confermata tramite biopsia, esami del sangue, ecografia e in ultima analisi, autopsia.
Altri trentasei cuccioli, sono stati prodotti dall’accoppiamento di questo maschio con sette persi partner tutti omozigoti (affected), con dimostrazione del livello apparente basso di penetranza del gene in questione.
In un altro caso, una femmina SCWT che omozigote per la mutazione (affected), solo una volta ha prodotto in una cucciolata di sette cani, un cucciolo con JRD clinica. La displasia renale, anche in questo caso è stata diagnosticata da autopsia.
Indipendentemente dal genotipo dello stallone se (“portatore” eterozigote o omozigote per l’allele mutato), tutti i cuccioli ottenuti da una madre omozigote (affected) o portatrice (eterozigote = un allele mutato + un allele “non mutato” o sano) avrebbero almeno una copia del gene mutato.
In un solo caso uno dei fratelli, il cucciolo colpito da JDR, è stato testato, ed è risultato omozigote “affected”).
In quest’ultimo esempio, una femmina omozigote (affected) è stata accoppiata con uno stallone “clear” (che non ha neanche un allele mutato, ma tutti e due sani). Pertanto, tutti i figli sono portatori (eterozigoti) dell’allele mutato.
In uno solo dei cuccioli di questa cucciolata è stata fatta diagnosi di JRD da autopsia. Il padre, che era esente e aveva già prodotto 11 cucciolate, prima di questa, senza cuccioli con JRD segnalata. Questo esempi, mostra che anche i portatori possono sviluppare la malattia, mentre nel primo esempio riportato sopra, solo alcuni animali che erano omozigoti per l’allele mutato hanno sviluppato la JRD.
Pertanto, l’ereditarietà si può definire dominante, che può essere trasmesso da un genitore solo, ma a penetranza incompleta, perché altrimenti tutti gli omozigoti per il gene mutato, manifesterebbero tutti la displasia renale, cosa che non avviene, come dimostrato dagli esempi sopra riportati.
Infine, nei precedenti esempi, non tutti gli animali che hanno la mutazione in forma omozigote “affected” o eterozigote “carrier” sviluppano questa malattia. Così, l’ereditarietà è dimostrata essere dominante con penetranza incompleta.
Come può il nuovo test essere utilizzato, per eliminare questo malattia genetica da una razza, senza compromettere il patrimonio genetico della stessa?
I test genetici sono progettati per gestire ed infine eliminare le malattie in questione senza compromettere la persità in un pool genico. Se avete appena scoperto che il vostro cane è un portatore o portatrice della mutazione per la displasia renale, niente panico!
Avete la possibilità di gestire ed eliminare questa malattia.
La frequenza di questa mutazione è estremamente alta in molte razze.
Questa mutazione è stata elusiva e impossibile da eliminare prima dello sviluppo di un test genetico, per il fatto che la malattia si manifesta sporadicamente, e perché è ereditata con penetranza incompleta, il che significa che un animale che porta questa mutazione, può essere privo di sintomi clinici della malattia, ma può ancora trasmetterla alla sua progenie.
Come in ogni pratica di allevamento è necessario considerare i tratti positivi e negativi di ogni riproduttore, in che modo i tratti ereditati dai genitori possano raggiungere l’equilibrio migliore, completandosi a vicenda.
Tutti i cani (e gli organismi viventi) sono portatori di mutazioni multiple.
Se in un animale si verifica una malattia genetica, non necessariamente è il risultato di una scelta d’allevamento scadente, ma può essere dovuta alla casualità (fatalità) legata all’ereditarietà.
Anche se il tasso di mutazione esatto per la specie canina è difficile da determinare, per estrapolazione da altre specie, c’è una buona probabilità, che in ogni soggetto nato si sia prodotta almeno una nuova mutazione genica.
Pertanto, in ogni nuova generazione o cucciolata, sorgono nuove mutazioni , ma dal momento che sono presenti in bassa frequenza, vengono generalmente perse negli accoppiamenti successivi.
Non esiste un animale geneticamente perfetto!
I Cromosomi sono presenti nelle cellule in coppia, uno ereditato da parte del padre e uno da parte della madre.
I cani hanno 39 coppie di cromosomi. Ogni set o coppia è composta da due cromatidi, una semplice mutazione in un gene a trasmissione recessiva, in uno solo dei cromosomi, forniti dal padre o dalla madre, con la presenza dell’altro cromosoma “sano” (= in cui non si è verificata la mutazione), sempre ereditato da uno dei due genitori, non si verifica la malattia genetica, in quanto quell’unico cromosoma non mutato definito dominante (in questo caso a penetranza completa)*, consente la sintesi di una quantità sufficiente di proteine che permettono la sopravvivenza degli animali affetti da una mutazione di tipo recessivo, in presenza di soggetti eterozigoti per l’allele portante la mutazione (allele = forma persa uno stesso gene codificante per un dato carattere)*.
Nel caso di una mutazione dominante, una sola copia del cromosoma che trasporta la mutazione è sufficiente per produrre la malattia, anche negli eterozigoti se la penetranza è completa *.
Con l’inpiduazione di una delle molte mutazioni che l’animale può avere, ora è possibile procedere all’eliminazione di questa mutazione identificata mediante test
genetico, e non inavvertitamente selezionare una mutazione deleteria nel vostro animale portatore.
Eliminazione all’ingrosso dei soggetti portatori è la peggior decisione che si possa fare! In quanto porta ad una deplezione del patrimonio genetico della razza.
Quali sono le informazioni che il test del DNA fornisce effettivamente all’allevatore?
I risultati del test del DNA possono essere riportati come segue:
- Carrier (= portatore) – (eterozigote per una copia della mutazione per la JRD);
- Affected (= omozigote per l’Allele Mutante (due copie della mutazione per la JRD);
- Clear – nessuna copia della mutazione JRD è presente.
Con un risultato a) e b) di cui sopra – l’animale è potenzialmente interessato dalla JRD o la potrebbe passare sulla sua progenie.
Come faccio a inviare il DNA dei miei cani per il test?
DOGenes per il test del DNA, utilizza un kit di 3 tamponi, con prelievo di materiale biologico per “spazzolamento” di cellule dalla parte interna della guancia, con un tampone denominato “cheek swab”, che viene fornito al proprietario per la raccolta e spedizione al laboratorio.
Vengono richiesti tre campioni per ogni cane. Il proprietario preleva il campione e poi lo spedisce per l’analisi.
Le decisioni di allevamento
Per le razze con un’alta frequenza della mutazione JRD, come decidere in base ai risultati:
1. Il mio cane è esente “clear”.
Può essere utilizzato con un soggetto portatore “carrier”.
Molte razze con una frequenza molto elevata della mutazione JRD, al fine di tutelare il patrimonio genetico, questo tipo di accoppiamento è necessario.
Sperando di ottenere un cucciolo “clear”, da questo incrocio che ha i tratti positivi di entrambi i genitori (statisticamente da questo accoppiamento si ha la probabilità del 50% di ottenere “clear” e il 50% di ottenere “carrier”)*.
2. Il mio cane è un portatore “carrier”. Idealmente, questo animale dovrebbe essere incrociato con un animale “clear”.
La Progenie “clear” ottenuta da questo accoppiamento, sarà quella riprodotta in futuro. Vi è una probabilità del 50% in questo caso di produrre nella prima generazione soggetti “clear”.
Se non esistono altre opzioni, questo animale dovrà essere accoppiato con un altro portatore “carrier”. In questo caso, la probabilità di produrre un soggetto “clear” nella prima generazione è del 25%. Tuttavia, c’è una probabilità del 25% che un nasca un soggetto “affected” (omozigote per l’allele mutante), e il 50% di eterozigoti “carrier”.
3. Il mio cane è omozigote per l’allele mutante, ma in buona salute (senza segni clinici), e porta altri tratti positivi della razza.
Questo è un processo di allevamento in due fasi, per ottenere un soggetto “clear”
(= esente). Questo cane o cagna deve essere accoppiato con un soggetto esente “clear”. Tutti i cuccioli nella prima generazione saranno “carrier” (eterozigoti).
Non c’è bisogno di eseguire un test del DNA in questo punto, perché sappiamo di partenza come sono geneticamente i genitori.
Un cucciolo portatore eterozigote della prima generazione, verrà scelto, e poi riprodotto in futuro, in seconda generazione, per la produzione di soggetti come nell’esempio nel punto 2.
L’ultima meta di questo percorso, sarà accoppiare un soggetto esente del proprio allevamento con un altro esente, ed ottenere l’eliminazione totale della mutazione dal proprio allevamento senza compromettere il pool genico.
Utilizzare la propria conoscenza con saggezza.
Proteggi il tuo Pool Genico per preservare la variabilità genetica nella vostra razza.
DOGenes Inc.
- Traduzione operata dalla dr. Elisabetta Venturini, su concessione della dr. Mary H. Whiteley Ph.D.
- (note aggiunte da Elisabetta Venturini – DMV)*.
La Dr. Elisabetta Venturini e la Società Italiana Collies, ringraziano il Dr. Mary H. Whiteley (Ph.D), la DOGenes Inc. per la loro disponibilità, e per avere concesso la pubblicazione sul sito della S.I.C. dell’ articolo informativo sulla JRD disponibile on-line sul sito https://www.dogenes.com/ e la sua traduzione per informare i soci della Società Italiana Collies.